上海精瑞科学仪器有限公司代理商
12 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
公司新闻/正文
Exosome外泌体纯化新思路--BIA Separations
1874 人阅读发布时间:2023-11-14 15:51

以无血清细胞培养上清液为样本,该方法被开发用以富集不含宿主蛋白和 DNA 污染物的外泌体。该过程也可应用于其他源材料,如补充血清的细胞培养产物或包括血浆、血清或尿液在内的体液,但可能需要进一步的工艺开发才能产生最佳结果。
该方案被设计用于处理 50 mL 澄清细胞培养产物。这需要使用 1 mL 整体柱,这一规模可用于初始工艺开发。色谱方法的放大很简单,主要归结为在相同柱体积 (CV) 中沿用同一梯度持续时间,在 CV 中使用相同的流速(如果可能),应用相同的上样量(mg 样品/mL 柱体积),此外还要考虑柱外体积效应。
体柱
CIMmultus™ QA 1 mL Monolithic Column (2 μm channels) (Catalog number: 311.5113-2)
色谱柱
CIMmultus™ QA 1 mL 整体柱(2 μm 通道)(货号:311.5113-2)
缓冲液和溶剂
使用去离子水制备所有溶剂,并在使用前通过 0.2 µm 过滤器过滤。
对于整合了耐盐核酸酶处理的 TFF:
• 2L去离子水 (dH2O)
• 1L 0.5 M NAOH
• 1L TFF/耐盐核酸酶缓冲液:50 mM Tris-HCl,500 mM NaCl,pH 8.0
• 500 mL 流动相 A 缓冲液:50 mM Hepes,20 mM NaCl,pH 7.0
对于色谱:
• 1L 流动相 A 缓冲液:50 mM Hepes,20 mM NaCl,pH 7.0
注意:盐浓度可升高至能保留外泌体在柱上的最高值。较高的盐分有利于去除杂质。• 500 mL 流动相 B 缓冲液:50 mM Hepes,2.0 M NaCl,pH 7.0
• 250 mL 柱清洗液:1.0 M NaOH 2.0 M NaCl
• 250 mL 柱再生溶液:1.0 M 醋酸铵
• 50 mL CIP 中和溶液:1.0 M 乙酸
• 1L 去离子水
• 50 mL 存储缓冲液:50 mM Hepes、100 mM NaCl、pH 7.0(不需要滴定)
样品制备
准备澄清的细胞培养产物。通过离心(建议 4,000 x G 离心 10 分钟)去除细胞和碎片,并通过 0.45 μm 注射过滤器过滤,对于更大体积,使用 0.45或0.65 μm 囊式过滤器。我们建议使用聚醚砜 (PES)过滤膜。
避免冻融步骤。为获得最佳结果,请使用新鲜细胞培养产物并遵循无冻融循环的步骤。冻结和解冻可能会导致上样时样品聚集和压力增加。
TFF 设置
除了 TFF,还可以使用系统蠕动泵。选择合适的 TFF 模块:TFF 模块孔隙率应尽量大,用以保留产物。可使用截留值介于 300 kDa 和 750 kDa 之间的 TFF 中空纤维过滤器(例如 mPES MidiKros® 和 MicroKros®,Repligen)或等效膜类产品。具有较小孔隙的膜将保留较大比例的污染物。选择合适的化学介质以防止产品与膜/纤维表面结合,例如 PES 或 mPES。作为 TFF 的替代品,可以使用具有 300 kDa 或 100 kDa 截留值或等效的 Vivaspin。
1. 将 TFF 模块连接到您的系统。
2. 用适量的指定用于 TFF 模块水合的 dH2O 冲洗。确保每种溶剂/缓冲液被冲洗到渗透出口端。
3. 用 0.5 M NaOH(或 TFF 模块指定的清洁溶液)再循环 1 小时
4. 用 500 mL dH2O 冲洗或直至 pH 为中性。
5. 用 250 mL TFF/耐盐核酸酶缓冲液(50 mM Tris-HCl,500 mM NaCl,pH 8.0)冲洗或直至 pH 为 8.0。
结合耐盐核酸酶的 TFF
分别取TFF前的样品、第一次过滤的样品、耐盐核酸酶处理后的样品和第二次过滤的样品,以确定外泌体回收率和污染物去除情况。通过对渗透物取样检查 TFF 模块的完整性,并测试是否存在泄漏(产品现状)。
- 检查您在第一步过滤时使用的缓冲液是否正确::TFF/耐盐核酸酶缓冲液(50 mM Tris-HCl,500 mM NaCl,pH 8.0)。
- 准备用于耐盐核酸酶处理的样品:将过滤后的样品倒入 TFF 系统,并以恒定的滞留体积进行缓冲液交换,直到渗透体积为 6 倍透析体积 (DV)。推荐的跨膜压力 (TMP) 为 2–3 psi。不要超过 3 psi。推荐进料速度:40–100 mL/min。如果 TMP 增加,则降低进料速度。
- 用耐盐核酸酶处理:停止流动并将 TMP 设置为零(关闭渗透阀或手动关闭渗透出口)。每 50 mL 澄清细胞培养物添加 1.25 U 耐盐核酸酶。根据制造商的说明(例如,使用 Saltonase、HL-Nuclease (EN32)、Blirt),添加活化剂 MgCl2,浓度至少为 1 mM Mg2+。在室温下以低流量再循环 1-2 小时。
- 将您的渗滤缓冲液更换为流动相 A 缓冲液(50 mM Hepes、20 mM NaCl、pH 7.0)。
- 去除残留的耐盐核酸酶和水解产物:释放渗透液流并将 TMP 恢复到 2–3 psi。以恒定滞留体积更换缓冲液,用于另外 6 DV。现行方案建议进行 2 次渗滤,每次 6 个渗滤体积。根据您的产品经验减少或增加渗滤。
- 收集保留物并用 10 mL 流动相 A 缓冲液冲洗 TFF 膜以获得更好的回收率。您的样品已准备好用于色谱分析。
- 如有必要,将您的 TFF 保留物在 4°C 下保存过夜。如若需长期储存,请将保留物冷冻至 -80°C。
- 清洁 TFF 模块:按照您的 TFF 模块推荐程序,如用 0.5 M NaOH 清洁 1 小时。确保清洗渗透出口。用 dH2O 冲洗掉残留的 NaOH直到 pH 值接近中性。将模块存放在 20% 的乙醇中。
在 CIMmultus QA 柱上运行阴离子交换层析
使用支持 1–10 mL/min 流速、线性梯度的液相色谱系统,包括电导率监测器和流通池路径长度为 2–10 mm 的 UV 监测器。10 mm 的光程将提供更高的灵敏度。1. 确保您的系统和色谱柱是干净的(按照说明手册或寻求帮助)。
2. 将 LC 系统的最大压力限制设置为 1.8 MPa(柱前压力)。根据指导手册中的流向说明连接色谱柱。
3. 用 20 mL 无菌过滤去离子水冲洗柱子。
4. 根据指导手册用 10 mL 流动相 A、10 mL 流动相 B 和 10 mL 流动相 A 平衡色谱柱。
5. 继续使用 10 mL 流动相 A 来设置色谱运行的基线。
6. 在开始色谱运行之前,检查柱后的电导率和 pH 值,使其与流动相 A 的电导率和 pH 值相匹配。 使用电导率监测器和 254 nm (260 nm) 和 280 nm 的紫外吸光度监测色谱运行情况。
在开始之前,请检查样品是否已完全解冻并检查是否有沉淀迹象。如果样品包含可见的颗粒,请通过 0.45 PES 过滤器过滤。样品可能略微粘稠。如有必要,降低加载过程中的流速。
1. 与色谱柱结合:以 5-10 mL/min (5-10 CV/min) 的流速将 50 mL 起始原料中经 TFF 耐盐核酸酶处理的样品的全部体积上样到柱子上。观察上样过程中的压力曲线,如果压力呈指数上升,则中断上样。
2. 用至少 20 mL 流动相 A 清洗未结合的物质。
3. 将流速降低至 1 mL/min进行馏分收集。可选择在更高流量下运行。以非常高的浓度洗脱 EV 会导致压力增加。以低流速洗脱或使用压力控制工具(如果可用)(Akta 系统)并将压力释放阀设置为 0.5-1 MPa。
4. 设置梯度以在 20 个柱体积(20 分钟,流速 1 mL/min)中达到 100% 流动相 B。收集组分 - 外泌体将在此步骤中洗脱。要获得更高的 EV 浓度,请缩短梯度或逐步洗脱。为了提高分辨率,增加梯度长度。
5. 用 1 M NaOH 2 M NaCl 溶液洗脱粘在柱子上的物质并收集原位清洗 (CIP) 峰。出于分析目的,用 1.0 M 乙酸或等效物中和 CIP 峰部分。
6. 分析含有外泌体的组分。
7. 按照程序进行清洁和再生。
简而言之,用至少 10 CV 的柱清洗液(1 M NaOH、2 M NaCl)冲洗色谱柱。可以通过缓慢的清洗液再循环将其延长至 1 小时。用水(10 CV)冲洗掉清洗液,并用柱再生液中和 pH,直至柱出口处的 pH 值与再生溶液的 pH 值相匹配。收集含有外泌体的组分。对于长期储存,将组分缓冲液交换为选择的配方缓冲液,例如 50 mM Hepes 100 mM NaCl pH 7.0 或用流动相 A 稀释并储存在 -80 °C。请按照色谱柱随附的说明手册进行 CIMmultus QA 的清洁和再生,或者在需要帮助时联系我们。
无需酶预处理的简化工艺
该工艺旨在以尽可能小的剪切应力快速纯化EVs。省略了 TFF 和其他柱前衍生步骤,以缩短处理时间并降低向 EV 颗粒引入剪切应力的风险。尽管 TFF 发挥着重要作用,但它的好处可能是有代价的。据报道TFF 过程中产生的剪切应力会剥离脂质包膜病毒的外层包膜,并使非脂质包膜病毒的脆性衣壳破裂。
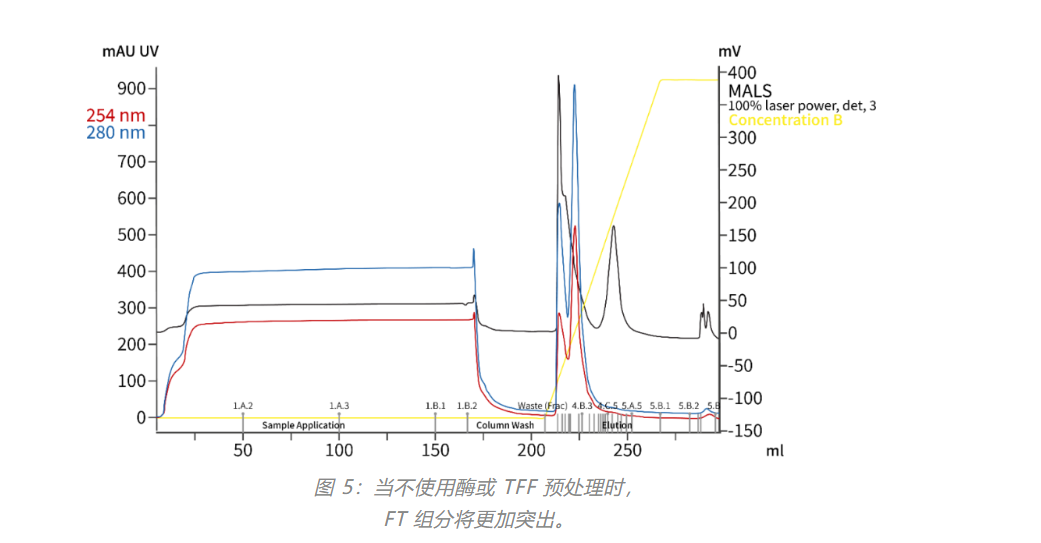
对于不包括 TFF 的流程,请使用“在 CIMmultus QA 上运行的阴离子交换色谱”中所述的相同流程步骤。请改用以下流动相:• 流动相 A:50 mM HEPES、50 mM NaCl、1 % 山梨醇、0.05 % 泊洛沙姆,pH 7.5注意:盐浓度可升高至能保留外泌体在柱上的最高值。较高的盐分有利于去除杂质。• 流动相 B:洗脱缓冲液:50 mM HEPES、2 M NaCl、1% 山梨醇、0.05% 泊洛沙姆,pH 7.5• 柱清洗溶液:1 M NaOH、2 M NaCl• 柱再生溶液:1.0 M 醋酸铵,pH ~7.0(无需滴定)。 除了离心和过滤之外,使用缓冲液 A 稀释样品以达到上样过程的柱结合条件。 此方法的示例色谱图可在图 5 中找到。工艺开发和放大建议
该方案描述了为用不同培养基及补充成分的天然干细胞和 HEK 细胞培养产物推荐的起始程序。CIMmultusTM QA柱的结合能力取决于您的产品 (EVs) 浓度和样品中的污染物。可通过实验确定每个样品的浓度和污染物。应使用 TFF 和核酸酶或替代方法尽量减少与EV竞争性结合色谱柱的宿主细胞蛋白质和 DNA,以确保 CIMmultusTM QA 柱的最大容量。根据我们的经验,最多可将 1000 mL 预处理的含 EV 样品加载到 1 mL 柱中。请注意,最佳结合量在总容量的 60-80% 范围内,扩大规模时需考虑。CIMmultusTM QA 色谱柱提供GMP 和非 GMP 形式的全体积范围产品用于工艺开发和制造,欢迎与我们取得联系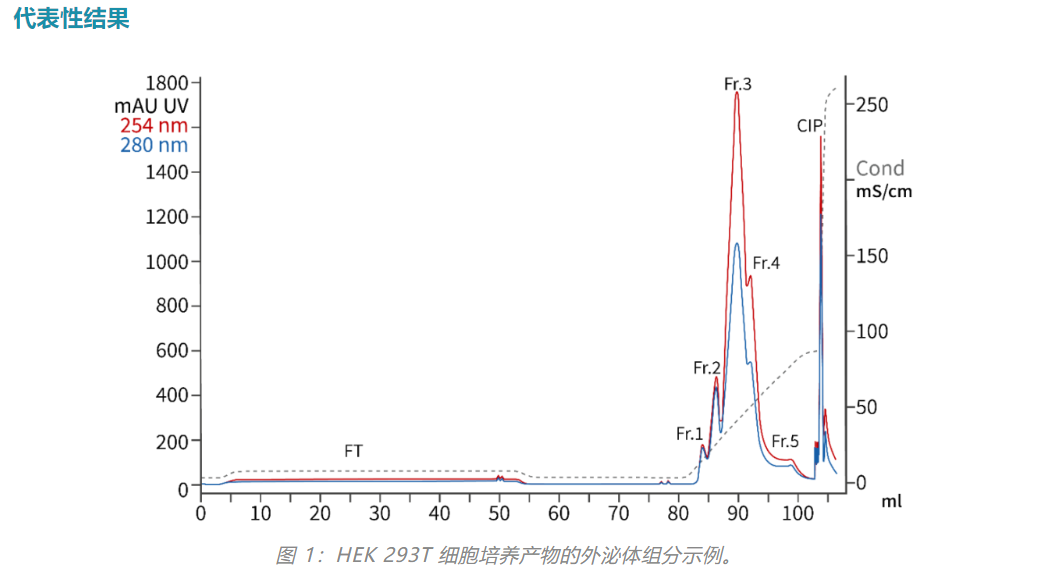
色谱图展示了从HEK 293T 无血清细胞培养产物运行阴离子交换色谱的示例。在 254 nm 和 UV 280 nm 处监测吸光度。使用具有 750 kDa 截留值的 TFF 和耐盐核酸酶制备上样样品。根据在盐梯度中洗脱的峰收集组分。分析流穿 (FT)、组分 1–5 (Fr. 1–5) 和就地清洗 (CIP) 组分的外泌体相关表面抗原(图 3)。
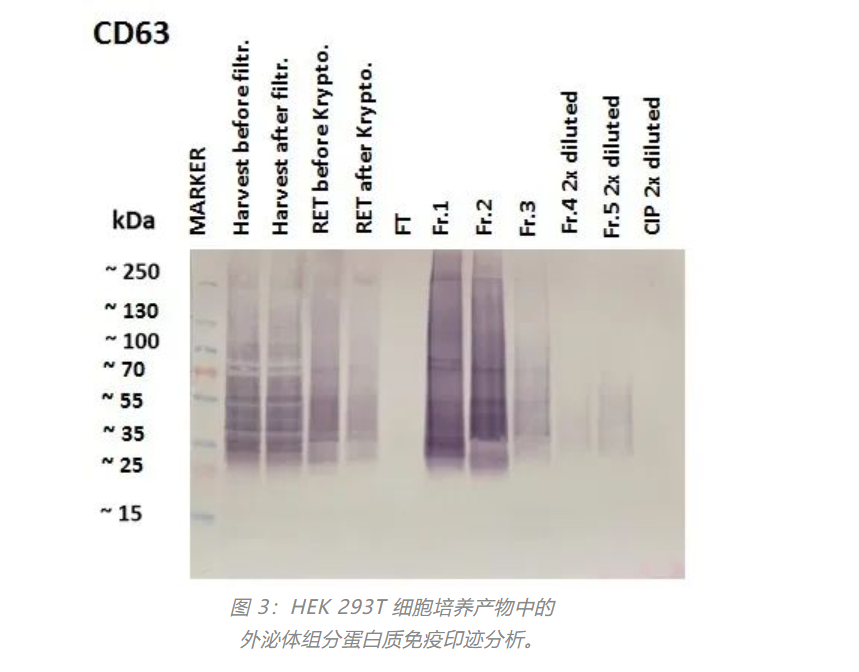
HEK 293T 产物、TFF 滞留物和 AEX 层析运行的组分(图 1)用 SDS PAGE 分离,并用Western blots分析外泌体特异性抗原 CD-63。FT 和 CIP 部分中没有外泌体。外泌体富集于 Fr.1 和 Fr.2 组分。请注意 Fr.1 和 Fr.2 之间染色模式的差异,这意味着它们代表不同的外泌体群体。

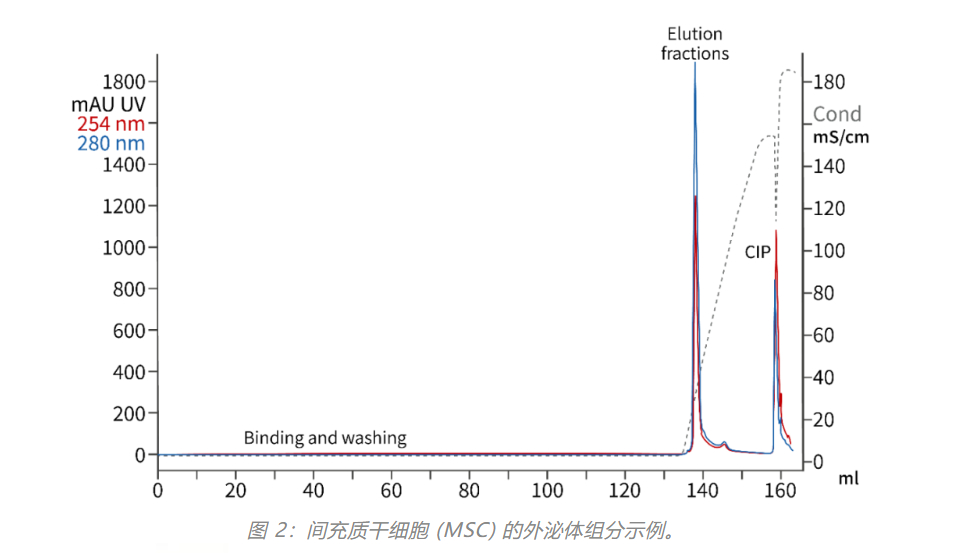
源材料(图 4:左)是澄清 HEK 293T 细胞培养产物。产物用具有集成耐盐核酸酶的 TFF 处理(图 4:中间)。最后,来自 TFF 滞留物的外泌体在 AEX 整体柱上浓缩和分离。SEC 色谱图(图 4:右)代表组分 Fr.1。
一直以来,BIA Separations是质粒DNA、AAV、mRNA高效率纯化的引领者。不仅提供整体柱及平台方法,还提供定制的纯化服务,以满足质粒DNA、AAV、mRNA规模化生产的纯化需求。





